摘要:安瓿瓶作为一种广泛应用于医药行业(尤其是注射剂型)的注射药液包装容器,因其高密封性,在开启过程中易产生玻璃碎屑,并可能混入药液。这些不溶性微粒在注射时若随药液进入人体,将带来潜在的安全风险。为此,本文通过系统比较不同安瓿瓶开启方式与所产生不溶性微粒数量的关系,筛选出适宜的开启方法,并在此基础上总结出一套较为规范、完整的安瓿瓶开启操作流程。
关键词:安瓿瓶,不溶性微粒,开瓶方法。
一、概念和背景介绍
不溶性微粒,药典中定义为溶液中除气泡以外非故意引入的、可移动的、不溶性粒子。是那些肉眼通常看不见,但实际存在于药液(尤其是注射液)中的微小“杂质"。
安瓿瓶,一种用于盛装注射用药液、疫苗、血清等无菌制剂的密封玻璃小瓶。主要的特点是高密封性,以此来保证药液的稳定,同时隔绝外部环境的影响,防止灰尘的落入等。常见的开瓶方式有用手掰开安瓿瓶,用专门的开瓶工具,或者是用镊子敲开等。不同的打开方式对于药液的影响不同,尤其是对不溶性微粒的影响更大,依据不溶性微粒的大小和数量我们来筛选出一种合适的开瓶方式。
二、不溶性微粒检测
人体的静脉大小在4μm~7μm,血管中的不溶性微粒(这里包含碎玻璃)会导致肉芽肿,静脉炎,同时堵塞血管,导致局部栓塞坏死等等。所以不溶性微粒对于人体的危害很大,目前已是各国药典强制要求检测项。现行各国药典对于不溶性微粒检测的限值基本一致,只是在"大/小容量"划分上,CP以100mL为大容量,USP将100mL归为小容量。
中国药典针对不溶性微粒检测对应的为章节<0903>,其中针对不溶性微粒检测有完整的方法和要求。目前药典检测不溶性微粒的方法学有几种:光阻法,显微计数法和流式成像法。中国药典以前两项作为检测方法。光阻法是主流检测方法,传统的显微镜法无法避免人为因素导致计数的偏差,主观性强;而且人工计数对实验员的集中度和眼睛直接观察要求很高,长期观察显微镜并进行计数容易导致视力下降,并引发一些眼部疾病;同时人工计数的测试结果重复性差。对比传统的显微镜法,光阻法省时省力,同时收集大量粒子信息,避免偶然误差。所以药典建议显微镜法只适合去检测光阻法不适合检测的样品。
三、不溶性微粒检测设备介绍
这里我们以Entegris旗下的PSS AccuSizer A2000(以下简称A2000)不溶性微粒检测仪作为介绍对象。检测原理如下图所示:
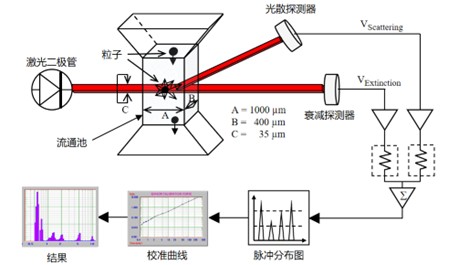
图1.SPOS法原理图
粒子通过光感区域时阻碍了一部分入射光,引起到达检测器的光强降低,此信号的衰减幅度理论上与粒子的横截面成比例关系。在仪器中,将光强信号转换成电信号,具体表现为电压值,不同粒径大小的粒子产生的电压值不同,根据对应关系,就可以建立标准粒子和粒径大小的校准曲线。这就是传统的光阻法(Light Extinction, LE,也称为光消减,Light Obscuration,LO)检测粒径的原理。传统光阻法的范围下限一般到1.5μm。Entegris(PSS)开创性地将光阻(LE)信号和光散(Light Scattering,LS)信号有机地结合起来,通过光阻效应获得较大的粒径检测范围,通过光散射增加对小粒子的灵敏度,大大拓展了单颗粒计数的下限到0.5μm。
相较于其他的光阻法设备,A2000是使用SPOS技术,它结合了光阻效应和光散理论,将颗粒计数的下限下探到0.5μm。这不仅迎合了更严苛的质量要求,也助力于精密制造对环境杂质的高标要求,同时也更符合药典及法规的更新趋势。
四、研究内容
1)开瓶方式[1]
这里我们引用日本学者河崎阳一关于安瓿切割时混入的不溶性微粒的研究中所做实验,获得下图中的三组对比数据。这三种开瓶方式都是先用砂轮在安瓿瓶颈部刻出划痕,之后进行开瓶,对比不溶性微粒的数量和大小。具体数据和分析结果如下:
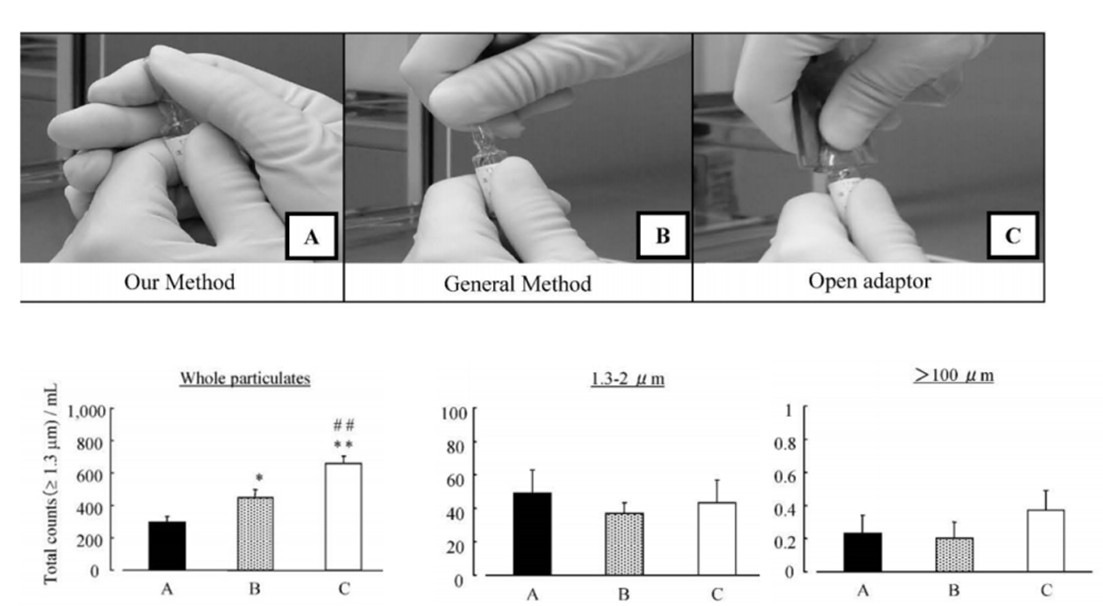
图2.三种开瓶方式及其粒度分布(A.双手持握安瓿瓶颈部提起开启B.药品说明书记载的方法C.使用切割辅助工具)
A所采用的开瓶方式是双手持握安瓿瓶颈部后同时用力提起。与另外两种方法相比,安瓿瓶切割部位承受的负荷较小,所产生的玻璃碎屑最少。正因如此,这种方法在抑制不溶性微粒混入方面好。B按照安瓿瓶使用说明书操作开瓶时,切割部位会形成支点承受较大外力,导致大量不溶性微粒产生。此外,C使用安瓿切割辅助工具开封安瓿时,由于其操作方式与说明书中的方法相同,因此除了按照说明书方法开封时可能产生的不溶性微粒外,还可能混入来自安瓿切割辅助工具的微粒。
对比图2中的三组不溶性微粒数据我们也可以看出,A方法所产生的不溶性微粒最少。
2)酒精棉擦拭[1]
上一个实验依据已经筛选出了一个合适的开瓶方式,即双手持握安瓿瓶颈部提起。而酒精棉擦拭安瓿瓶这一步骤很早就已开始使用,这一操作是否有效和必要有待商榷。我们还是以日本学者河崎阳一的实验结果为例,他使用酒精棉搭配六种不同的溶剂对安瓿瓶进行擦拭前后对照实验,以此来判断擦拭的效果如何。结果如下:

图3.使用不用溶剂擦拭安瓿瓶后开瓶的不溶性微粒分布
图3中使用的溶剂分别为:a)kcl溶液b)普鲁卡因c)泛醇100mg d)50%葡萄糖e)盐酸雷莫司琼f)氯苯胺。图中横坐标表示粒子大小,纵坐标表示粒子数量,黑色为对照组,白色为使用酒精棉擦拭后的测试结果。
实验数据显示,使用酒精棉擦拭安瓿瓶确实可以减少不溶性微粒的产生。但是减少程度与使用溶剂种类有关。在某些情况下(如使用氯苯胺时)有效,而在其他情况下效果有限。酒精棉擦拭减少了部分的不溶性微粒的原因主要有以下两点: 1.清除安瓿瓶上附着的异物及微生物; 2.减少切割玻璃安瓿时产生的玻璃碎片混入。考虑到其在清除表面异物和微生物方面的明确作用,以及其本身引入微粒的风险极低,所以酒精棉擦拭步骤在标准操作流程中仍具有重要价值。
3)开瓶流程及优化[2]
上文中主要是针对不同的安瓿瓶不同打开方法的对比,那么下面我们来看一下,滨州医学院附属医院的冯萍老师对此做的另一个研究。
基于上述两个实验结果,先确定一套基础的安瓿瓶开启流程,即砂轮划痕-酒精棉擦拭-手掰折断(定义为对照组)。在此基础上为了进一步降低不溶性微粒的影响,滨州医学院附属医院的老师在砂轮划痕后加了一步流水冲洗,然后置于水平层流台和生物安全柜风干(表中实验组),然后对比优化前后药液的不溶性微粒数量。具体的实验方法如下:
试验药品选用临床常用药品 10%kcl注射液(10mL 非易折型玻璃安瓿包装)为代表,操作人员选取从事药品集中调配 3 年以上工作人员 4 名,经标准操作强化培训 1 周,试验组与对照组各开启 10%kcl注射液 200 支,50 支/人,记录每支安瓿开启时间(试验组前处理时间不计算在内),测定每支开启后安瓿内不溶性微粒(大于 5μm)数量。按照 《中国药典》通则 0903 光阻法(全体积)测定同批次 10%KCL注射液中不溶性微粒(大于 5μm)数量作为基础数量。计算每只安瓿开启后不溶性微粒(大于 5μm)增加数量。试验在水平层流台、生物安全柜中分别进行测试。实验结果如下:
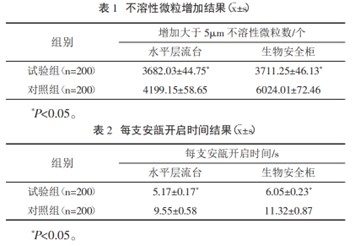
从表1中可以看到实验组的颗粒数不管是在水平层流台还是生物安全柜上风干,最后的不溶性微粒数量都要小于对照组,说明加入流水冲洗后风干这一步对于不溶性微粒的控制是有效果的。在风干后仍保持棉签消毒这一项是为了去除附着在瓶颈处的空气中的不溶性微粒。表2是优化前后开启安瓿瓶所需的时间,优化后的流程耗时约10秒,在临床操作的可接受范围内。所以优化后的流程其实是更适合作为医护平时的开瓶方式。
四、分析总结
从本文中几个实验中可以看出,开瓶方式显著影响微粒水平,双手持握安瓿瓶颈部同时用力提起的方式,产生的微粒最少。同时使用酒精棉擦拭的效果与溶剂种类相关,虽对微粒总数的降低作用不一,但作为常规消毒和清洁步骤仍需要。而在标准流程(砂轮划痕-消毒-折断)中增加 “流水冲洗-水平层流台风干" 步骤,可进一步有效降低不溶性微粒数量,且操作时间仍在临床可接受范围内。
综上,本研究推荐采用 “砂轮划痕-流水冲洗-水平层流台风干-溶剂擦拭-双手持握折断" 的优化流程,以控制不溶性微粒的引入,保障患者的用药安全。
五、展望
我们可以看出,用药安全越来越受重视而且规范措施也越来越丰富,因此我们必须严把质量关。这也正是各国药典强制要求对不溶性微粒进行检测的原因。随着医药行业的持续发展和法规的日益严格,相关检测设备的性能与标准也需与时俱进,不仅要满足当前要求,更要前瞻性地覆盖未来的检测需求。
除本文中的实验外,像山东省医疗器械和药品包装检验研究院就基于ANSYS软件[3],针对安瓿瓶的受力角度、割痕位置等参数展开了深入分析,旨在确保药瓶质量并降低不溶性微粒的影响。与此同时,市面上也陆续出现了多种改进型的开瓶器[4]。这些都是在寻求更好的安瓿瓶开瓶方法。
本文中所述的不溶性微粒检测也是如此,像传统光阻法受限于其物理特性,检测下限通常为1.5μm。而本文所采用的A2000不溶性微粒分析仪,在光阻法基础上创新引入光散射技术,将检测下限显著推进至0.5μm。值得注意的是,0.5μm至1.5μm范围内的不溶性微粒更易引发血管栓塞等风险,因而更应引起重视。像FDA针对蛋白制品中就提到过0.1μm-10μm大小的微粒对于药物的治疗作用影响也很大。因此,虽然目前不溶性微粒的检测法并未提及,但是实现更低的检测下限已成为行业共识,这也是符合未来药典与国际法规的更新趋势,也将为药品安全提供更坚实的保障。